Важливим чинником поліпшення якості освіти та забезпечення рівного доступу до вищої освіти є зовнішнє незалежне оцінювання. Досвід попередніх років упровадження зовнішнього незалежного оцінювання дозволив зробити певні узагальнення. По-перше, очевидними стали невміння учнів працювати з тестовими завданнями та слабка обізнаність учителів у використанні тестових технологій. По-друге, тестові завдання найчастіше містять матеріал на закріплення знань, якими наші учні володіють недостатньо. По-третє, як показав аналіз відповідей учасників тестування, більшість учнів правильно розв’язує лише репродуктивні завдання, на відтворення фактичних знань. Отже, з огляду на це навчальні заклади системи середньої освіти повинні допомогти учням належно підготуватися до участі в зовнішньому незалежному оцінюванні.
Учителям біології, хімії доцільно протягом навчального року використовувати завдання у формі тестів під час тематичного контролю знань і поточного оцінювання. Крім того, тестові завдання можуть використовуватися й на етапі актуалізації вивчення тієї чи іншої теми, закріплення знань тощо. Така форма роботи не лише сприятиме адаптуванню учнів до системи зовнішнього оцінювання, а й стане в нагоді вчителеві в повсякденній роботі. Адже тести прості в застосуванні, значно економлять час при проведенні опитування, що дозволить використовувати їх для інших форм роботи на уроці. До того ж, тестові завдання виконують не лише функцію контролю якості знань, а й навчальну функцію.
Під час формування варіантів тестів для тематичного оцінювання чи інших форм роботи учителю може допомогти ознайомлення з принципами побудови тесту для зовнішнього незалежного оцінювання. Зовнішнє незалежне оцінювання з хімії також є письмовим за формою і складається з 50 завдань. На виконання тесту з хімії відводиться 150 хвилин. Щодо форм тестових завдань, то у тестовому зошиті передбачені:
завдання з вибором однієї правильної відповіді з чотирьох запропонованих;
- завдання на встановлення відповідності (логічні пари), які складаються зі спільного вступного запитання та чотирьох завдань, позначених цифрами, до кожної з яких потрібно дібрати один варіант відповіді з п’яти запропонованих і позначених буквою й записати його в таблицю;
- завдання на встановлення правильної послідовності, у яких потрібно розташувати певні дії (поняття, формули, характеристики) у правильній послідовності, де перша дія (поняття, формула, характеристика) відповідає цифрі 1, друга — 2 і т. д., і записати цю послідовність у таблицю.
Окрім цих трьох типів завдань, до тестового зошита з хімії включено завдання відкритої форми з короткою відповіддю. Запропоновані завдання передбачають запис певного числа, яке і є відповіддю на поставлене запитання.
Аналізуючи результати виконання сертифікаційної роботи, слід відмітити теми шкільного курсу хімії, які потребують особливої уваги вчителів:
1. Загальна хімія:
- Основні поняття і закони хімії;
- Розчини;
- Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва. Хімічний зв’язок.
2. Неорганічна хімія:
- Основні класи неорганічних сполук;
- Металічні елементи;
- Неметалічні елементи.
3. Органічна хімія:
- Вуглеводні;
- Оксигеновмісні органічні сполуки;
- Нітрогеновмісні органічні сполуки.
Так кількісно розподілено завдання ЗНО за змістовими блоками в 2017 році (таблиця 1—2)
Таблиця 1
| № з/п | Змістовий блок | Кількість завдань | Частка від загальної кількості завдань (%) |
| 1 | Загальна хімія | 11 | 22 |
| 2 | Неорганічна хімія | 15 | 30 |
| 3 | Органічна хімія | 16 | 32 |
| 4 | Обчислення в хімії | 8 | 16 |
| Усього | 50 | 100 |
Кількісний розподіл завдань за формами 2017 рік (Таблиця 2)
| Змістовий блок | |||||
| Форма завдання | Загальна хімія | Неорганічна хімія | Органічна хімія | Обчислення в хімії | Усього |
| З вибором однієї правильної відповіді | 9 | 14 | 11 | – | 34 |
| На встановлення відповідності | 1 | 1 | 4 | – | 6 |
| На встановлення правильної послідовності | 1 | – | 1 | – | 2 |
| Відкритої форми з короткою відповіддю | – | – | – | 8 | 8 |
| Разом | 11 | 15 | 16 | 8 | 50 |
Для успішного виконання завдання з вибором однієї правильної відповіді, яких є 34, учень повинен мати глибокі знання найважливіших законів і теорій хімії; складу, класифікації, властивостей, способів добування й галузей застосування речовин — представників різних класів неорганічних сполук; складу, номенклатури, будови, властивостей і способів добування органічних речовин. Також завдання цієї форми скеровано на перевірку вмінь використовувати інформацію, що міститься в періодичній системі хімічних елементів; визначати склад ядра й електронних оболонок атомів, загальну кількість електронів та число електронів на зовнішньому енергетичному рівні атомів хімічних елементів; визначати ступені окиснення хімічних елементів у сполуках, в окисно-відновних реакціях — окисник і відновник, процеси окиснення й відновлення; полярність чи неполярність ковалентного зв’язку; прогнозувати фізичні властивості речовини з урахуванням типу кристалічних ґраток.
Як конкретний приклад проаналізуємо вимоги до навчальних досягнень учнів при вивченні теми «Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва. Будова атома». Від учня вимагається:
- Уміти зображати схему будови атомів елементів 1—3 періодів. Мати чіткі знання про планетарну модель атома.
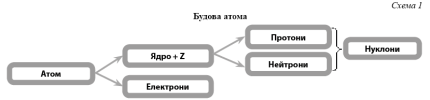
Атом складається з позитивно зарядженого ядра та електронів, що обертаються навколо нього (схема 1). У ядрі зосереджена майже вся маса атома, при цьому воно займає дуже малий об’єм: розміри ядра й атома складають 10-15 м і близько 10-10 м відповідно. Кількість електронів в атомі дорівнює заряду ядра Z.
- Усвідомити фізичний зміст порядкового номера елемента: порядковий номер не просто номер
у створеній системі, а й важлива константа для кожного елемента, яка виражає заряд ядра атома, вказує на число протонів та електронів (схема 2).
- Засвоїти закономірності зміни хімічних елементів та їхніх сполук за періодами та групами.
Простежимо зміну властивостей елементів та їх сполук, залежно від будови атомів, на прикладі ІІІ періоду (таблиця 3 ).
Учням можна запропонувати зіставити кількісні й якісні зміни в будові атомів елементів від Na до Cl і зробити висновки про те, що кількісні зміни (число протонів у ядрі й відповідно число електронів, що утворюють електронний шар) переходять у якісні (характер властивостей простої речовини й сполук, утворених елементами). Заряди ядер атомів (кількісні зміни) зростають монотонно, лінійно. Від Na до Cl металічність (якісна характеристика) поступово змінюється неметалічністю. Потім — різкий стрибок: зміна типового неметалу — галогену Cl інертним елементом — Ar; зміна інертного елемента типовим металом К. Кількісні зміни переходять у якісні стрибкоподібно. У першому випадку (Cl — Ar) це пояснюється завершенням електронного шару; у другому (Ar — К) — появою нового електронного шару.
Усвідомлення учнями знань про перехід кількісних змін у якісні має важливе значення, оскільки такий перехід лежить в основі хімічних явищ.
Основні закономірності змін характеристик елементів у групі
| Параметр | У підгрупі |
| Заряд ядра | збільшується |
| Кількість електронів на зовнішньому енергетичному рівні | не змінюється |
| Кількість енергетичних рівнів | збільшується |
| Радіуси атомів | збільшуються |
| Електронегативність | послаблюється |
| Металічні властивості | посилюються |
| Неметалічні властивості | послаблюються |
| Властивості вищих оксидів та гідратів, які їм відповідають | Основні властивості посилюються, а кислотні — послаблюються |
На підтвердження актуальності теми: «Періодичний закон та будова атома» наводжу зразки завдань ЗНО останніх років:
| Рік | К-ть завдань | Номер завдання |
| 2015 (основне) | 6 | 2, 3, 4, 5, 43, 44 |
| 2016 (основне) | 3 | 2, 3, 36 |
| 2017(основне) | 2 | 2, 3 |
| 2016 (пробне) | 3 | 2, 4, 35 |
| 2017 (пробне) | 4 | 2, 3, 35, 42 |
Людмила Калатур, учителька хімії СЗШ № 314, м. Київ
газета “Хімія”, №4 квітень 2018